Sa mga unang oras ng Disyembre 29, inilathala ng NEJM online ang isang bagong clinical phase III na pag-aaral ng bagong Chinese coronavirus VV116.Ang mga resulta ay nagpakita na ang VV116 ay hindi mas masahol kaysa sa Paxlovid (nematovir/ritonavir) sa mga tuntunin ng tagal ng klinikal na pagbawi at nagkaroon ng mas kaunting masamang mga kaganapan.
Pinagmulan ng larawan:NEJM
Median na oras ng pagbawi 4 na araw, adverse event rate 67.4%
Ang VV116 ay isang oral nucleoside na anti-new coronavirus (SARS-CoV-2) na gamot na binuo sa pakikipagtulungan nina Junsit at Wang Shan Wang Shui, at isang RdRp inhibitor kasama ng remdesivir ng Gilead, molnupiravir ng Merck Sharp & Dohme at azelvudine ng Real Biologics.
Noong 2021, natapos ang isang phase II na klinikal na pagsubok ng VV116 sa Uzbekistan.Ang mga resulta ng pag-aaral ay nagpakita na ang VV116 group ay maaaring mas mapabuti ang mga klinikal na sintomas at makabuluhang bawasan ang panganib ng pag-unlad sa kritikal na anyo at kamatayan kumpara sa control group.Batay sa mga positibong resulta ng pagsubok na ito, ang VV116 ay naaprubahan sa Uzbekistan para sa paggamot ng mga pasyente na may katamtaman hanggang sa malubhang COVID-19, at naging unang bagong oral coronary na gamot na naaprubahan para sa marketing sa ibang bansa sa China [1].
Ang phase III na klinikal na pagsubok na ito[2] (NCT05341609), pinangunahan ni Prof. Zhao Ren ng Shanghai Ruijin Hospital, Prof. Gaoyuan ng Shanghai Renji Hospital at Academician Ning Guang ng Shanghai Ruijin Hospital, ay nakumpleto sa panahon ng outbreak na dulot ng variant ng Omicron ( B.1.1.529) mula Marso hanggang Mayo sa Shanghai, na may layuning suriin ang bisa at kaligtasan ng VV116 kumpara sa Paxlovid para sa maagang paggamot sa mga pasyenteng may banayad hanggang katamtamang COVID-19.Ang layunin ay suriin ang bisa at kaligtasan ng VV116 kumpara sa Paxlovid para sa maagang paggamot ng mga pasyenteng may banayad hanggang katamtamang COVID-19.
Pinagmulan ng larawan: Sanggunian 2
Isang multicentre, observer-blinded, randomized, controlled trial ng 822 adultong pasyente ng Covid-19 na may mataas na peligro ng pag-unlad at may banayad hanggang katamtamang mga sintomas ang isinagawa sa pagitan ng Abril 4 at 2 Mayo 2022 upang masuri ang pagiging karapat-dapat ng mga kalahok mula sa pitong ospital sa Shanghai, Tsina.Sa huli, 771 kalahok ang nakatanggap ng alinman sa VV116 (384, 600 mg bawat 12 oras sa araw 1 at 300 mg bawat 12 oras sa araw 2-5) o Paxovid (387, 300 mg nimatuvir + 100 mg ritonavir bawat 12 oras sa loob ng 5 araw) bilang gamot sa bibig.
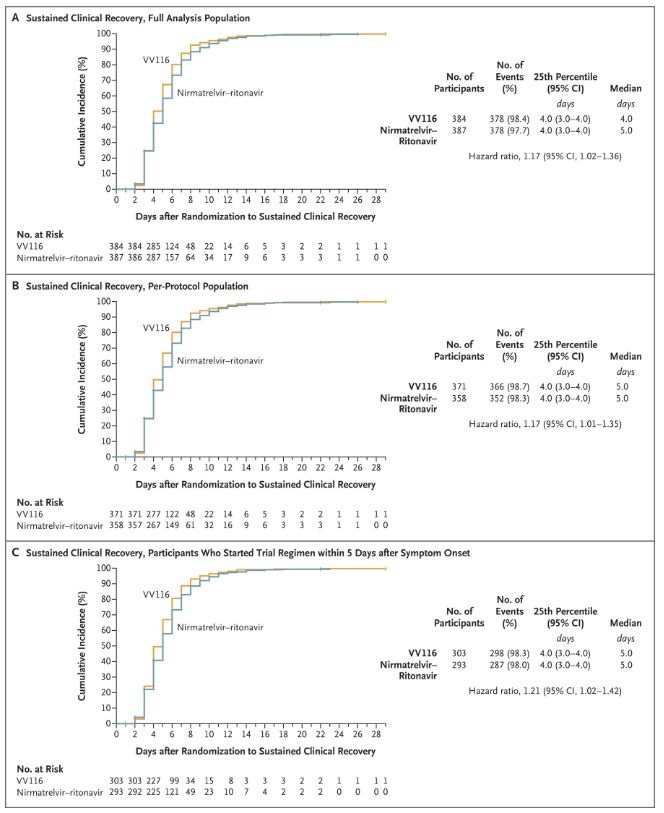
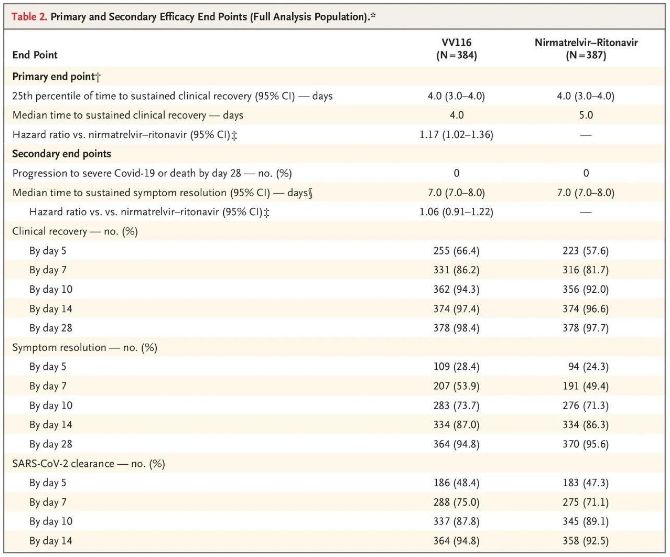
Ang mga resulta ng klinikal na pag-aaral na ito ay nagpakita na ang maagang paggamot sa VV116 para sa banayad hanggang sa katamtamang COVID-19 ay nakamit ang pangunahing endpoint (oras para sa sustained clinical recovery) na hinulaang ng clinical protocol: ang median na oras hanggang sa clinical recovery ay 4 na araw sa VV116 group at 5 araw sa pangkat ng Paxlovid (hazard ratio, 1.17; 95% CI, 1.02 hanggang 1.36; mas mababang limitasyon. >0.8).
Pagpapanatili ng oras ng klinikal na pagbawi
Pangunahin at pangalawang efficacy endpoints (komprehensibong pagsusuri ng populasyon)
Pinagmulan ng larawan: Sanggunian 2
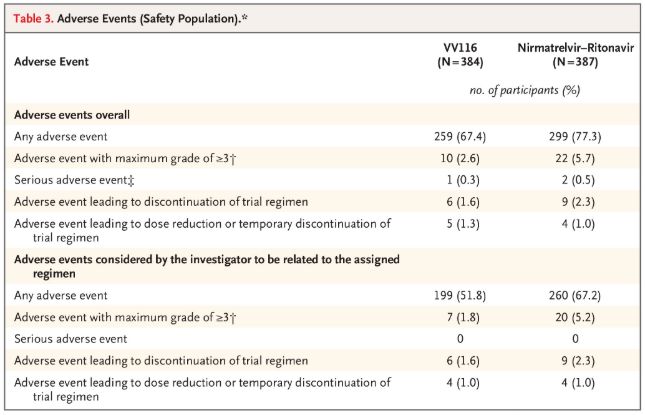
Sa mga tuntunin ng kaligtasan, ang mga kalahok na tumatanggap ng VV116 ay nag-ulat ng mas kaunting mga salungat na kaganapan (67.4%) kaysa sa mga tumatanggap ng Paxlovid (77.3%) sa 28-araw na pag-follow-up, at ang saklaw ng Grade 3/4 na mga salungat na kaganapan ay mas mababa para sa VV116 (2.6% ) kaysa kay Paxlovid (5.7%).
Mga masamang kaganapan (mga ligtas na tao)
Pinagmulan ng larawan: Sanggunian 2
Mga kontrobersya at tanong
Noong Mayo 23, 2022, isiniwalat ni Juniper na ang klinikal na pag-aaral ng pagpaparehistro ng Phase III ng VV116 kumpara sa PAXLOVID para sa maagang paggamot ng banayad hanggang katamtamang COVID-19 (NCT05341609) ay nakamit ang pangunahing endpoint ng pag-aaral nito.
Pinagmulan ng larawan: Sanggunian 1
Sa panahong kulang ang mga detalye ng paglilitis, ang kontrobersya na nakapalibot sa Phase III na pag-aaral ay dalawang beses: una, ito ay isang single-blind na pag-aaral at, sa kawalan ng placebo control, ito ay pinangangambahan na ito ay mahirap hatulan. ang gamot ay ganap na layunin;pangalawa, may mga tanong tungkol sa mga klinikal na endpoint.
Ang mga pamantayan sa klinikal na pagsasama para sa Juniper ay (i) mga positibong resulta para sa bagong pagsusuri sa korona, (ii) isa o higit pang banayad o katamtamang sintomas ng COVID-19, at (iii) mga pasyenteng may mataas na panganib ng malubhang COVID-19, kabilang ang kamatayan.Gayunpaman, ang tanging pangunahing klinikal na endpoint ay 'oras para sa matagal na klinikal na pagbawi'.
Bago ang anunsyo, noong Mayo 14, binago ni Juniper ang mga klinikal na endpoint sa pamamagitan ng pag-alis ng isa sa mga klinikal na pangunahing endpoint, "proporsyon ng mga conversion sa malubhang sakit o kamatayan" [3].
Pinagmulan ng larawan: Sanggunian 1
Ang dalawang pangunahing punto ng pagtatalo na ito ay partikular ding tinugunan sa nai-publish na pag-aaral.
Dahil sa biglaang pagsiklab ng Omicron, ang paggawa ng mga placebo tablet para kay Paxlovid ay hindi pa nakumpleto bago ang simula ng pagsubok at samakatuwid ay hindi nagawa ng mga investigator ang pagsubok na ito gamit ang isang double-blind, double-mock na disenyo.Tulad ng para sa single-blind na aspeto ng clinical trial, sinabi ni Juniper na ang protocol ay isinagawa pagkatapos ng komunikasyon sa mga awtoridad sa regulasyon at ang single-blind na disenyo ay nangangahulugan na hindi malalaman ng investigator (kabilang ang evaluator ng endpoint ng pag-aaral) o ang sponsor. ang partikular na therapeutic na paglalaan ng gamot hanggang sa ang huling database ay mai-lock sa pagtatapos ng pag-aaral.
Hanggang sa panahon ng huling pagsusuri, wala sa mga kalahok sa pagsubok ang nakaranas ng kamatayan o pag-unlad sa isang malubhang kaganapan sa Covid-19, kaya walang mga konklusyon ang maaaring makuha tungkol sa bisa ng VV116 sa pagpigil sa pag-unlad sa malubha o kritikal na Covid-19 o kamatayan.Ang data ay nagpahiwatig na ang tinantyang median na oras mula sa randomization hanggang sa patuloy na pagbabalik ng mga sintomas na nauugnay sa Covid-19 na target ay 7 araw (95% CI, 7 hanggang 8) sa parehong mga grupo (hazard ratio, 1.06; 95% CI, 0.91 hanggang 1.22) [2].Hindi mahirap ipaliwanag kung bakit inalis ang pangunahing endpoint ng 'rate ng conversion sa matinding sakit o kamatayan', na orihinal na itinakda bago matapos ang pagsubok.
Noong 18 Mayo 2022, inilathala ng journal Emerging Microbes & Infections ang mga resulta ng unang klinikal na pagsubok ng VV116 sa mga pasyenteng nahawahan ng variant ng Omicron [4], isang bukas, inaasahang pag-aaral ng cohort na may 136 na kumpirmadong inpatient.
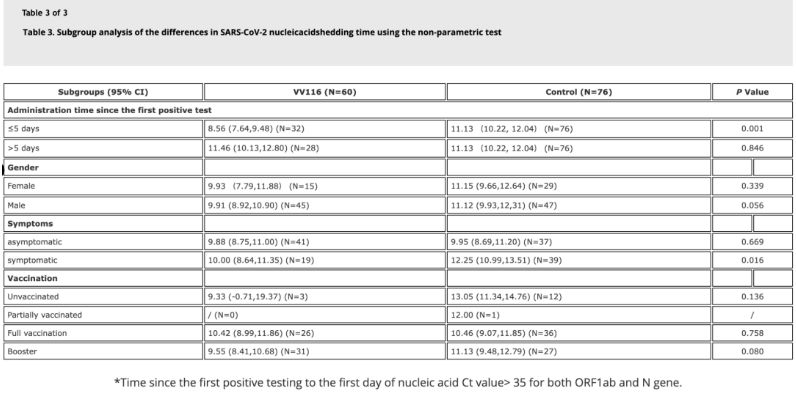
Ang data mula sa pag-aaral ay nagpakita na ang mga pasyenteng may impeksyon sa Omicron na gumamit ng VV116 sa loob ng 5 araw ng kanilang unang positibong pagsusuri ng nucleic acid ay may oras sa nucleic acid regression na 8.56 araw, mas mababa sa 11.13 araw sa control group.Ang pangangasiwa ng VV116 sa mga pasyenteng may sintomas sa loob ng takdang panahon ng pag-aaral na ito (2-10 araw ng unang positibong pagsusuri ng nucleic acid) ay nagbawas ng oras sa regression ng nucleic acid sa lahat ng mga pasyente.Sa mga tuntunin ng kaligtasan ng gamot, walang malubhang masamang epekto ang naobserbahan sa pangkat ng paggamot ng VV116.
Pinagmulan ng larawan: Sanggunian 4
Mayroong tatlong patuloy na klinikal na pagsubok sa VV116, dalawa sa mga ito ay phase III na pag-aaral sa banayad hanggang katamtamang COVID-19 (NCT05242042, NCT05582629).Ang iba pang pagsubok para sa katamtaman hanggang malubhang COVID-19 ay isang internasyonal na multicentre, randomized, double-blind phase III na klinikal na pag-aaral (NCT05279235) upang suriin ang bisa at kaligtasan ng VV116 kumpara sa karaniwang paggamot.Ayon sa anunsyo ni Juniper, ang unang pasyente ay na-enroll at na-dose noong Marso 2022.
Pinagmulan ng larawan:clinicaltrials.gov
Mga sanggunian:
[1]Junshi Biotech: Anunsyo sa pangunahing punto ng pagtatapos ng nakarehistrong klinikal na pag-aaral ng Phase III ng VV116 kumpara sa PAXLOVID para sa maagang paggamot ng banayad hanggang katamtamang COVID-19
[2]https://www.nejm.org/doi/full/10.1056/NEJMoa2208822?query=featured_home[3]https://clinicaltrials.gov/ct2/show/record/NCT05341609[4] Ensi Ma, Jingwen Ai , Yi Zhang, Jianming Zheng, Xiaogang Gao, Junming Xu, Hao Yin, Zhiren Fu, Hao Xing, Li Li, Liying Sun, Heyu Huang, Quanbao Zhang, Linlin Xu, Yanting Jin, Rui Chen, Guoyue Lv, Zhijun Zhu, Wenhong Zhang, Zhengxin Wang.(2022) Profile ng mga impeksyon sa Omicron at status ng pagbabakuna sa mga tatanggap ng 1881 liver transplant: isang multi-centre retrospective cohort.Emerging Microbes & Infections 11:1, pahina 2636-2644.
Oras ng post: Ene-06-2023
 中文网站
中文网站